Un tratamiento de omisión de exones que se utiliza para tratar la enfermedad de Duchenne.
VYONDYS 53 se utiliza para tratar a pacientes con distrofia muscular de Duchenne (DMD) que tienen una mutación confirmada en el gen de la distrofina que puede ser tratada mediante la omisión del exón 53.
Esta indicación está aprobada con aprobación acelerada según un aumento de la producción de distrofina en el músculo esquelético observado en pacientes tratados con VYONDYS 53. La aprobación continua para esta indicación puede estar supeditada a la verificación del beneficio clínico en ensayos confirmatorios.
Conozca a Nicholas, de 17 años de edad,
susceptible a la omisión del exón 53
¿Cómo funciona?
VYONDYS 53 es un tratamiento de omisión de exones que ayuda al cuerpo a producir una forma más corta de la proteína distrofina. Obtenga más información sobre VYONDYS 53 y los resultados de sus estudios clínicos.
Falta de proteína distrofina
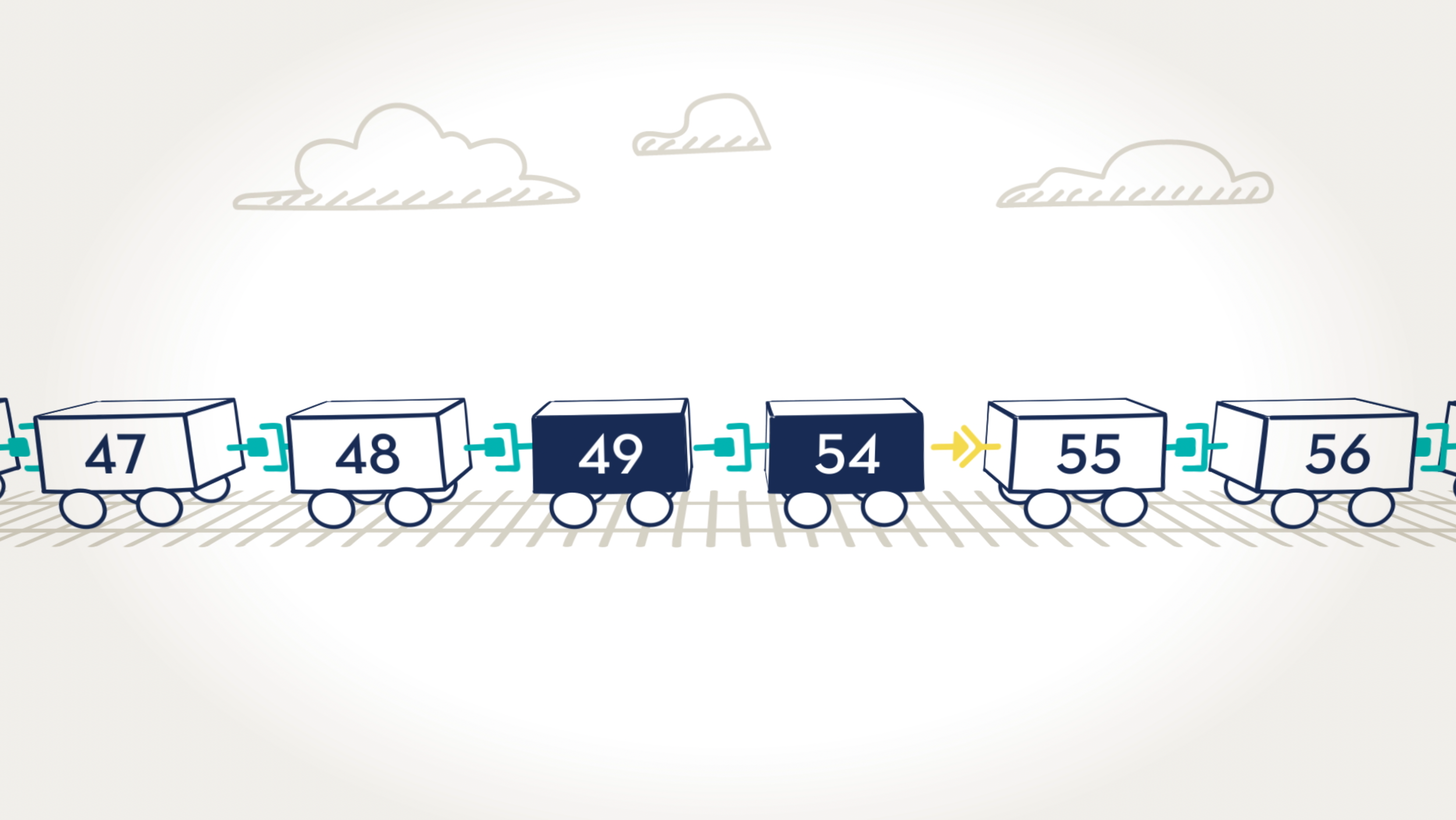
Las tecnologías para la omisión de exón intentan abordar el problema subyacente de la enfermedad de Duchenne: la falta de proteína distrofina. Muchas personas con la enfermedad de Duchenne tienen una mutación genética en la que faltan uno o más exones en el gen de la distrofina. Esto provoca errores en las instrucciones para producir distrofina, por lo que el cuerpo no puede producir esa proteína.
La omisión de exón indica al cuerpo que oculte un exón para que toda la sección pueda omitirse y el resto de los exones puedan unirse. VYONDYS 53 está diseñado para unirse al exón 53. VYONDYS 53 ayudó a algunos niños varones con DMD susceptibles a la omisión del exón 53 a producir una forma más corta de proteína distrofina.
Decisiones informadas.
Existen ciertos riesgos y efectos secundarios asociados a VYONDYS 53. Al igual que con cualquier medicamento, debe hablar con el médico de su hijo sobre los riesgos y efectos secundarios.

